【台灣醒報記者賴義中台北報導】幾乎能與死亡畫上等號的惡性腦瘤,可望有新法治療!台北榮總與陽明大學醫學團隊經多年研究,發現惡性腦瘤內的復發因子與癌幹細 胞間具高度相關,倘能針對該因子進行治療,就能有效抑制腫瘤生長。這項突破尚未應用至臨床階段,但可望取代現有化療藥物,嘉惠腦瘤病患。
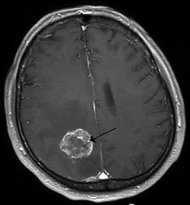
「多型性神經膠母細胞瘤」為最常見也是最惡性的膠質細胞瘤,台灣每年新增約200餘名病例,約占惡性腦瘤中4成比例,好發年齡為50至60餘歲。此種腦瘤具高度侵犯性,惡化極快且容易復發,患者平均存活率僅15個月,5年存活率亦低於10%。
現行治療方法多於手術部分切除後,針對殘留部分投藥進行化療及放射治療,但復發率仍接近100%。當前最有效的藥物Temozolomide僅能延長2.5個月的存活率,然所費不貲,單月療程就須花費20萬元。
研究團隊自2007年起,自惡性腦瘤中分離出癌幹細胞進行培養,並在其中發現微核糖核酸「MiR142-3p」,它與癌幹細胞自我更新和增殖能力有高度相關。
陽明大學藥理所教授邱士華表示,經動物實驗證實,「MiR142-3p」可有效調控癌幹細胞性質。若以「MiR142-3p」投藥注射至腦部,結果顯示,實驗動物的腦瘤能縮小一半以上,甚至停止生長。
這項研究結果已於國際發表,並獲刊載於《Molecular Cell》與《Biomaterials》等知名醫學期刊。目前研究團隊已申請人體臨床實驗許可,並期望有藥廠加入,成為開發治療惡性腦瘤新藥的契機。
惡性腦瘤致命性非常高,前中信創辦人辜濂松即因罹患惡性神經膠質腦瘤病逝,目前醫界在治療惡性腦瘤有重大突破,國立陽明大學與台北榮總研究團隊,找到惡性腦 腫瘤復發因子微小核糖核酸「miR142-3p」,對於診治癌症病患有相當大的幫助,並提供未來發展抗藥性與臨床復發治療標的轉譯醫學新方向。
腦部局部注射「miR142-3p」 可抑制腦腫瘤
陽明大學藥理所邱士華教授表示,研究團隊利用自惡性神經膠質腦瘤中分離分離培養癌症幹細胞,發現微小核糖核酸miR142-3p具有調控腦腫瘤幹細胞自我更新與增殖之能力;只要讓患者局部注射「miR142-3p」至腦部,就可抑制腫瘤。
新式抗癌醫療技術 豎立新里程碑
目前此應用微小核醣核酸的治療技術,已申請人體臨床實驗,不久將直接使癌症病患受惠。此外,在未來,台北榮總癌病中心將更進一步將配合非病毒載體傳 送系統等先進技術,運用於針對惡性腫瘤,以及目前人無法治癒之癌症幹細胞進行治療,為國人在發展新式抗癌醫療技術的研發歷程中,豎立新的里程碑。本項重大 研究突破已刊登於國際頂尖知名雜誌Molecular Cell December 12, 2013 52, 693–706。
成人惡性腦瘤 依惡性度分成三個等級
成人惡性腦瘤約有80%以上是由神經膠質細胞演變而來,在病理上依據惡性度的高低可以分成三個等級:
1.第一類惡性度最低的星狀細胞瘤。
2.第二類是惡性度判於中間的分化不良性星狀細胞瘤。
3.第三類是惡性度最高的多形性膠原母細胞瘤。
在臨床症狀的表現主要和腦瘤所侵犯的部位有關,常見一般症狀,例如:頭痛、噁心、嘔吐、厭食、痙攣、人格改變、情緒改變、認知功能障礙等等,如果腦瘤侵犯到運動、感覺、或言語區域,則病人可能會出現部份肢體無力或癱瘓、感覺異常或喪失、言語不能、視野缺損等特異的症狀。
針對棘手腦瘤,在臨床上醫師需要做詳細的理學、神經學檢查,並使用電腦斷層,磁振照影、神經影像學等檢查來做診斷。
環境污染 恐增加腦瘤的發生率
根據流行病學研究,已有某些環境因素被發現會增加腦瘤的發生率,包括:物理性因素,如游離輻射線、電磁波;化學性因素,如含氮硫化物的染料、殺蟲 劑、有機溶劑;生物性因素,如某些病毒與腦部的淋巴癌有關。此外,職業別研究也顯示某些形態腦癌通常發生在特定企業的工人身上,還有化學師和香料工人也有 較高的腦癌發生率。
(中央社記者龍瑞雲台北13日電)榮陽團隊研究造成惡性腦瘤復發的「癌症幹細胞」,找到調控的微小核糖核酸「miR142-3p」,未來可運用在治療及新藥研發。
陽明大學藥理所教授邱士華說,多型性膠質母細胞瘤(GBM)是常見且惡性度最高腦瘤,占惡性腦瘤患者4成,台灣每年約新增200至300名患者,好發年齡50至60歲,不過腫瘤惡化很快,患者平均存活約15個月,發生原因仍未知。
邱士華指出,治療癌症通常是手術切除,再透過放射及化學治療,不過惡性腫瘤也容易出現復發情況,近年來,醫界對於難治癒、易復發、會轉移進行許多研究,發現癌病組織中存在特定會造成復發的關鍵「癌症幹細胞」。
國立陽明大學與台北榮總研究團隊從惡性神經膠質腦瘤中分離並培養癌幹細胞,發現「微小核糖核酸miR142-3p」具調控腦腫瘤幹細胞,控制自我更新與增殖能力。
榮陽團隊指出,微核糖核酸(miR)可抑制蛋白質生合感,功能是用來調控基因表現或抑制基因表現,也在許多癌症中發現miR的影響。
邱士華說,針對腫瘤若採行一般療法,而癌幹細胞透過自我更新,又會讓腫瘤組織再生成而造成復發;若以癌幹細胞標靶療法,消除癌幹細胞,使其缺乏自我更新能力,造成腫瘤組織萎縮,而讓癌症病情獲得控制。
邱士華指出,miR142-3p對於可調控腦腫瘤幹細胞的增殖能力發現,在小鼠實驗可讓7至8成腫瘤消失,使腫瘤生長變為可控制。目前將申請人體臨床實 驗,估計可望成為腫瘤指標及治療標的,研究結果已刊登在頂尖期刊「分子生物學(Molecular Cell)」。1030113






 留言列表
留言列表

